Faq
Perguntas frequentes
- O que são triglicérides e qual sua importância?
Os lípides biologicamente mais relevantes são os fosfolípides, o colesterol, os triglicérides (TG) e os ácidos graxos.
• Os fosfolípides formam a estrutura básica das membranas celulares.
• Do ponto de vista químico, o colesterol é um álcool ou um éster, precursor dos hormônios esteroides, dos ácidos biliares e da vitamina D. Além disso, como constituinte das membranas celulares, o colesterol atua na fluidez das membranas celulares e na ativação de enzimas aí situadas (Figura 1 A).
• Os triglicérides, por sua vez, são formados a partir de três ácidos graxos ligados a uma molécula de glicerol e constituem uma das formas de armazenamento energético mais importantes no organismo, sendo depositados nos tecidos adiposo e muscular.
• Os ácidos graxos podem ser classificados como saturados (sem duplas ligações entre seus átomos de carbono), mono ou poli-insaturados, de acordo com o número de ligações duplas em sua cadeia.
• Os ácidos graxos saturados mais frequentemente presentes em nossa alimentação são: láurico, mirístico, palmítico e esteárico (que variam de 12 a 18 átomos de carbono). Entre os monoinsaturados, o mais frequente é o ácido oleico, que contém 18 átomos de carbono. Quanto aos poli-insaturados, podem ser classificados como ômega 3 (Eicosapentaenoico − EPA, Docosahexaenoico − DHA e linolênico), ou ômega 6 (linoleico), de acordo com presença da primeira dupla ligação entre os carbonos, a partir do grupo hidroxila.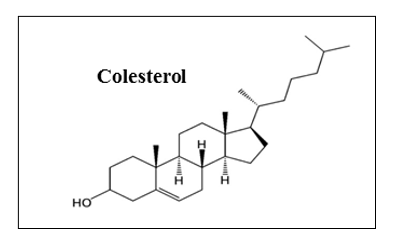
(A) Estrutura química do colesterol
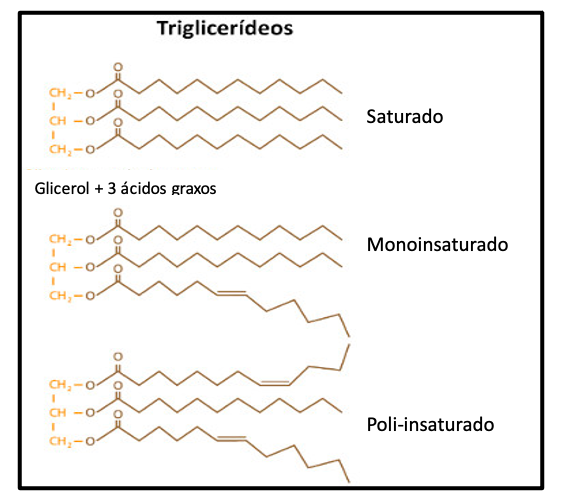
(B) Estrutura química dos triglicérides, compostos de três ácidos graxos e uma molécula de glicerol. Os ácidos graxos podem ser saturados (sem duplas ligações), monoinsaturados (com uma dupla ligação) e poli-insaturados (com mais de uma dupla ligação entre seus átomos de carbono)
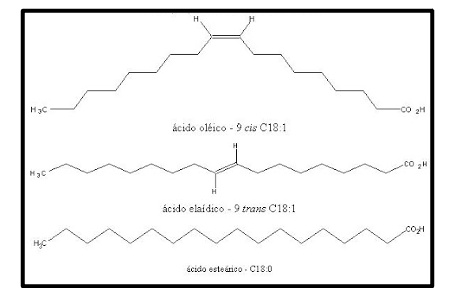
(C) Representação dos ácidos graxos oleico (ômega 9), elaídico e esteárico; destaque para os isômeros cis e trans
Figura 1. Representação esquemática do colesterol, triglicérides e ácidos graxos saturados.
Referências:
1. Izar MC, Lottenberg AM, Giraldez VZR, Santos Filho RDD, Machado RM, Bertolami A, et al. Position Statement on Fat Consumption and Cardiovascular Health - 2021. Arq Bras Cardiol. 2021; 116(1):160-212 - Como o colesterol e os triglicérides são transportados em nosso organismo?
• As lipoproteínas permitem a solubilização e o transporte dos lípides, que são substâncias geralmente hidrofóbicas, no meio aquoso plasmático. São compostas por lípides e proteínas denominadas Apolipoproteínas (apo). As apos têm diversas funções no metabolismo das lipoproteínas, como a formação intracelular das partículas lipoproteicas, caso das apos B100 e B48, e a atuação como ligantes a receptores de membrana, como as apos B100 e E, ou cofatores enzimáticos, como as apos CII, CIII e AI.
• Existem quatro grandes classes de lipoproteínas separadas em dois grupos: (i) as ricas em TG, maiores e menos densas, representadas pelos quilomícrons, de origem intestinal, e pelas Lipoproteínas de Densidade Muito Baixa (VLDL, sigla do inglês very low density lipoprotein), de origem hepática; e (ii) as ricas em colesterol, incluindo as LDL e as de Alta Densidade (HDL, do inglês high density lipoprotein). Existe ainda uma classe de Lipoproteínas de Densidade Intermediária (IDL, do inglês intermediary density lipoprotein) e a Lipoproteína (a) − Lp(a), que resulta da ligação covalente de uma partícula de LDL à Apo (a). A função fisiológica da Lp(a) não é bem conhecida, mas, em estudos mecanísticos e observacionais, ela tem sido associada à formação e à progressão da placa aterosclerótica (Figura 1).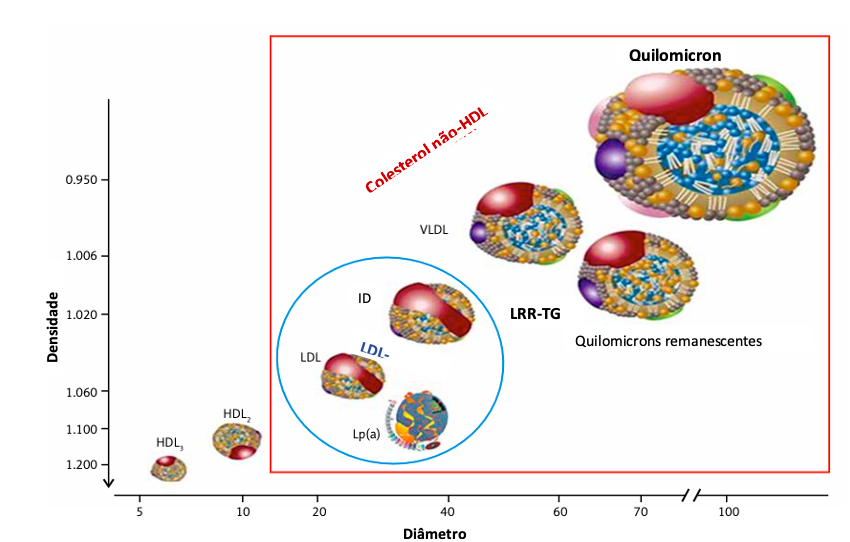
Figura 1. Representação esquemática das lipoproteínas plasmáticas.
Os lípides plasmáticos são transportados sob a forma de lipoproteínas, que possuem tamanhos e densidades distintos. As maiores, QM e VLDL têm menor densidade e maior tamanho. As LDLs e a Lp(a) possuem baixa densidade, um maior conteúdo de colesterol e menos triglicérides e as HDLs têm o menor tamanho e maior densidade, com alto conteúdo proteico e de colesterol. Todas as lipoproteínas são formadas por uma capa de fosfolípides, possuem triglicérides, ésteres de colesterol no interior e colesterol livre na superfície. Contém apolipoproteínas que participam como cofatores e servem para reconhecimento por receptores específicos. Os Quilomícrons, formados no intestino, as Lipoproteínas de Densidade Muito Baixa (VLDL, sigla do inglês very low density lipoprotein), de origem hepática, as lipoproteínas ricas em colesterol, incluindo as LDL (sigla do inglês low density lipoprotein) e as de Alta Densidade (HDL, do inglês high density lipoprotein). Existe ainda uma classe de Lipoproteínas de Densidade Intermediária (IDL, do inglês intermediary density lipoprotein) e a Lipoproteína (a) − Lp(a), que resulta da ligação covalente de uma partícula de LDL à Apo (a).Referências:
1 – Faludi AA, Izar MCO, Saraiva JFK, Chacra APM, Bianco HT, Afiune Neto A et al. Atualização da Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose – 2017. Arq Bras Cardiol 2017; 109(2Supl.1):1-76. - Como devemos dosar os triglicérides (TG)? Com ou sem jejum?
Como o estado alimentado predomina durante a maior parte do dia, o paciente está mais exposto aos níveis de lipídes nesta condição em comparação ao estado de jejum. Portanto, a condição pós-prandial pode representar mais eficazmente o potencial impacto dos níveis lipídicos no risco cardiovascular de um indivíduo.
As dosagens no estado pós-prandial são mais práticas, viabilizando maior acesso do paciente ao laboratório, com menor perda de dias de trabalho, abandono de consultas médicas por falta de exames e maior acesso à avaliação do risco cardiovascular.
A coleta de sangue no estado pós-prandial é mais segura em diversas situações e pode ajudar a prevenir a hipoglicemia por uso de insulina em pacientes com diabetes mellitus, ou por jejum prolongado no caso de gestantes, crianças e idosos, minimizando intercorrências e aumentando a adesão para realização de exames e o comparecimento às consultas médicas.
As determinações do colesterol total, HDL-C, não-HDL-C e LDL-C não diferem significativamente se realizadas no estado pós-prandial ou de jejum. Há aumento nos níveis de TG no estado alimentado; porém, este aumento é pouco relevante desde que se considere uma refeição usual não sobrecarregada em gordura, havendo a possibilidade de se ajustar os valores de referência (Figura 1).
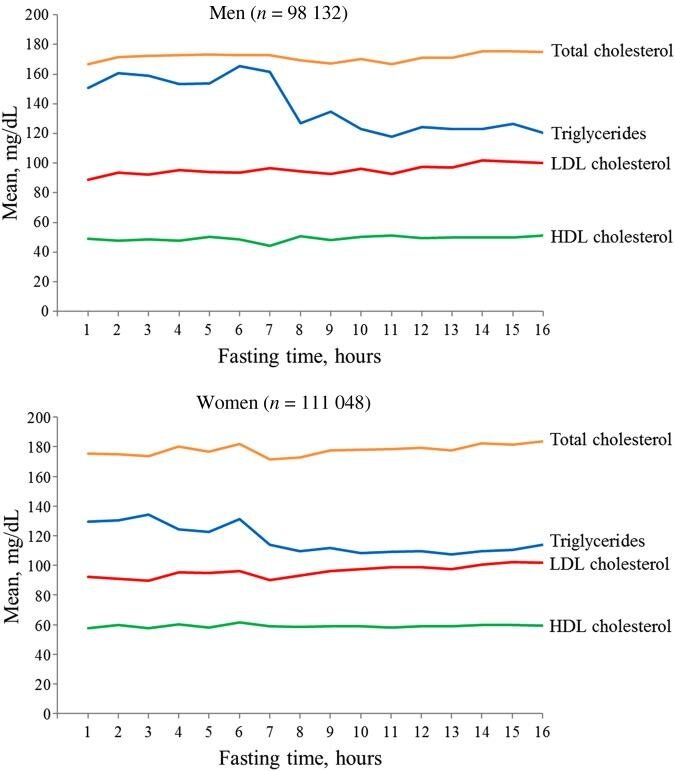
Figura 1. Concentrações médias dos lípides plasmáticos em função do tempo de jejum após a última refeição em homens e mulheres da população geral do Canadá.
Adaptado de Nordestgaard B, et al.Com a flexibilidade do jejum para o perfil lipídico, há maior amplitude de horários, reduzindo assim o congestionamento nos laboratórios, especialmente no início da manhã, o que traz mais conforto para o paciente.
Com os avanços tecnológicos nas metodologias diagnósticas, os principais ensaios disponíveis mitigaram as interferências causadas pela maior turbidez nas amostras, decorrentes de elevadas concentrações de TG. Contudo, há potenciais limitações, especialmente referentes ao cálculo da LDL-C, onde estudos de desempenho entre diferentes metodologias têm demonstrado a necessidade de revisão das práticas de utilização das fórmulas adotadas.
Porém, quando os níveis de TG no estado pós-prandial se encontrarem > 440 mg/dL ou na presença de situações especiais como recuperação de pancreatite por hipertrigliceridemia ou no início de tratamento com drogas que causem hipertrigliceridemia grave, será recomendado ao médico solicitante a prescrição de uma avaliação de TG com jejum de 12h.
Referências:
1 – Scartezini M, Ferreira CES, Izar MCO, et al. Posicionamento sobre a Flexibilização do Jejum para o Perfil Lipídico. Arq Bras Cardiol. 2017; 108(3):195-197.
2 - Nordestgaard BG, Langsted A, Mora S, etal; European Atherosclerosis Society (EAS) and the European Federationof Clinical Chemistry and Laboratory Medicine (EFLM) joint consensusinitiative. Fasting is not routinely required for determination of a lipid
profile: clinical and laboratory implications including flagging at desirableconcentration cut-points—a joint consensus statement from the EuropeanAtherosclerosis Society and European Federation of Clinical Chemistry andLaboratory Medicine. Eur Heart J. 2016;37(25):1944-58. - Quais as recomendações sobre o uso de fórmulas na estimativa do LDL-colesterol? Deve-se fazer a dosagem direta de LDL-C?
A estimativa do valor de LDL-c na avaliação sem jejum ou quando os TG estiverem muito elevados é em geral inacurada.
A avaliação do LDL-C pode ser realizada por dosagem direta ou estimada por cálculo com base nas fórmulas de Friedewald ou de Martin.
Com jejum: Quando utilizar a fórmula de Friedewald, existem limitações da falta de jejum e de valores de TG > 400 mg/dL para estimar o LDL-C, podendo -se nestes casos utilizar a fórmula de Martin, ou realizar a dosagem direta do LDL-C.Sem jejum: Na coleta de amostra pós-prandial, a avaliação do LDL-C pode ser realizada por dosagem direta ou cálculo através da fórmula de Martin.
Incluir o cálculo do não-HDL-C junto aos demais resultados do perfil lipídico para adultos, mesmo sem jejum, pois os níveis de TG não interferem neste cálculo. Os valores de VLDL-C; podem ou não ser reportados.
Fórmula de Friedewald: CT = HDL-c + TG/5 + LDL-c, onde TG/5 corresponde aos valores de VLDL-c.
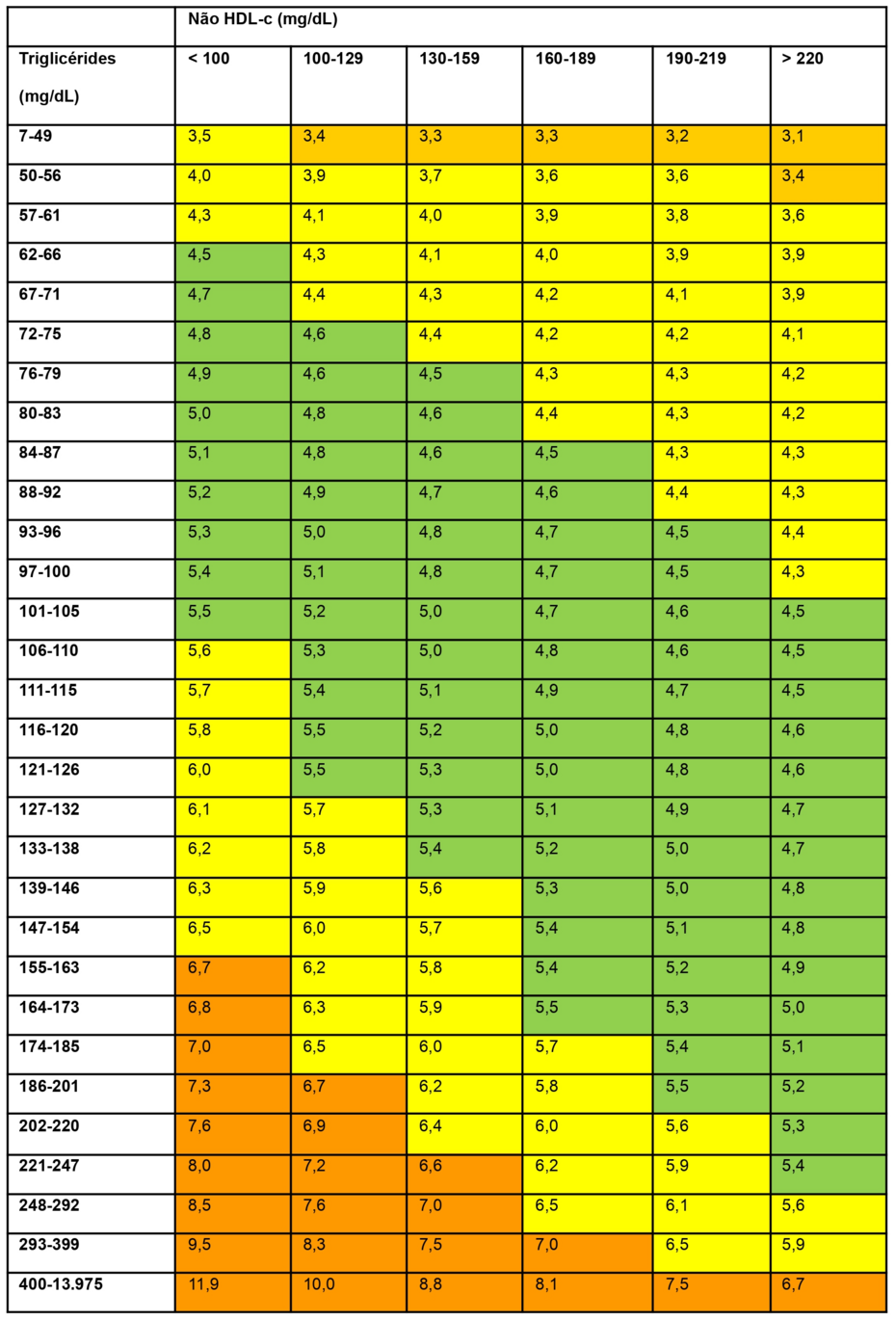
Recentemente, Martin et al. sugeriram outro método para estimar os valores de LDL-c, utilizando como referência a ultracentrifugação, e, por meio de cálculos estatísticos, definiram diferentes divisores para o valor de TG, que permitem estimar com maior fidedignidade os valores de VLDL-c.
Para obter estes divisores depende-se das concentrações do Colesterol Não HDL (não HDL-c) e do TG da amostra do paciente (Tabela 1). Com este novo divisor (x) aplica-se a fórmula: LDL-c = CT – HDL-c – TG/x, onde x varia de 3,1 a 11,9 (Grau de Recomendação: IIa; Nível de Evidência: C).Tabela 1. Valores utilizados para o cálculo do colesterol da lipoproteína de densidade muito baixa e posterior cálculo do colesterol da lipoproteína de baixa densidade.
Referências:
1 – Scartezini M, Ferreira CES, Izar MCO, et al. Posicionamento sobre a Flexibilização do Jejum para o Perfil Lipídico. Arq Bras Cardiol. 2017; 108(3):195-197.
2 – Martin SS, Blaha MJ, Elshazly MB, Toth PP, Kwiterovich PO, Blumenthal RS et
al. Comparison of a novel method vs the Friedewald equation for estimating
low-density lipoprotein cholesterol levels from the standard lipid profile.
JAMA. 2013; 310(19): 2061-681. - Quais são as vias de transporte de colesterol e triglicérides e quais os cofatores e enzimas que delas participam?
• Os triglicérides (TG) representam a maior parte das gorduras ingeridas. Após ingestão, as lipases pancreáticas hidrolisam os TG em ácidos graxos livres, monoglicerídeos e diglicerídeos. Sais biliares liberados na luz intestinal emulsificam estes e outros lípides oriundos da dieta e da circulação entero-hepática, com formação de micelas. A solubilização dos lípides sob a forma de micelas facilita sua movimentação através da borda em escova das células intestinais. A proteína Niemann-Pick C1-like 1 (NPC1-L1), parte de um transportador de colesterol intestinal, está situada na membrana apical do enterócito e promove a passagem do colesterol através da borda em escova desta célula, facilitando a absorção intestinal do colesterol. A inibição da proteína NPC1-L1, com consequente inibição seletiva da absorção intestinal do colesterol, tem sido reconhecida como importante alvo terapêutico no tratamento da hipercolesterolemia.
• Após serem absorvidas pelas células intestinais, as diversas partículas lipídicas, particularmente os ácidos graxos, são utilizadas na produção de quilomícrons, que também contêm ApoB48, o componente amino-terminal da ApoB100. Os quilomícrons são, em seguida, secretados pelas células intestinais para o interior do sistema linfático, de onde alcançam a circulação através do ducto torácico. Enquanto circulam, os quilomícrons sofrem hidrólise pela Lipase Lipoproteica (LPL), uma enzima localizada na superfície endotelial de capilares do tecido adiposo e músculos, com consequente liberação de ácidos graxos e glicerol do core, e de colesterol não esterificado da superfície destas partículas. Após este processo de lipólise, os ácidos graxos são capturados por células musculares e também adipócitos − estes últimos importantes reservatórios de TG elaborados a partir de ácidos graxos. Remanescentes de quilomícrons e ácidos graxos também são capturados pelo fígado, onde são utilizados na formação de VLDL. Esta é a via exógena ou intestinal.
• O transporte de lípides de origem hepática ocorre por meio das VLDL, IDL e LDL. As VLDL são lipoproteínas ricas em TG e contêm a ApoB100 como sua Apo principal. As VLDL são montadas e secretadas pelo fígado, sendo liberadas na circulação periférica. A montagem das partículas de VLDL no fígado requer a ação de uma proteína intracelular, a chamada proteína de transferência de TG microssomal (MTP, do inglês microsomal triglyceride transfer protein), responsável pela transferência dos TG para a ApoB, permitindo a formação da VLDL. A montagem hepática da VLDL também tem sido reconhecida como foco terapêutico no tratamento da hipercolesterolemia, seja pela inibição da síntese de Apolipoproteína B 100 (ApoB), ou pela inibição da MTP.
• Já na circulação, os TG das VLDL, assim como no caso dos quilomícrons, são então hidrolisados pela LPL, enzima estimulada pela ApoC-II e inibida pela ApoC-III. Os ácidos graxos assim liberados são redistribuídos para os tecidos, nos quais podem ser armazenados (como no tecido adiposo), ou prontamente utilizados, como nos músculos esqueléticos. Por ação da LPL, as VLDL, progressivamente depletadas de TG, transformam-se em remanescentes, também removidos pelo fígado por receptores específicos. Uma parte das VLDL dá origem às IDL, que são removidas rapidamente do plasma. O processo de catabolismo continua e inclui a ação da lipase hepática, resultando na formação das LDL.
• Durante a hidrólise das VLDL, estas lipoproteínas também estão sujeitas a trocas lipídicas com as HDL e as LDL. Por intermédio da ação da Proteína de Transferência de Ésteres de Colesterol (CETP, do inglês cholesteryl ester transfer protein), as VLDL trocam TG por ésteres de colesterol com as HDL e LDL. A CETP vem sendo testada como alvo terapêutico no tratamento de dislipidemias, em particular no tratamento da HDL baixa, e na redução do risco cardiovascular.
• A LDL tem um conteúdo apenas residual de TG e é composta principalmente de colesterol e uma única apo, a ApoB100. As LDL são capturadas por células hepáticas ou periféricas pelos Receptores de LDL (LDLR). No interior das células, o colesterol livre pode ser esterificado para depósito por ação da enzima Acil-CoA:Colesteril Aciltransferase (ACAT).
• A expressão dos LDLR nos hepatócitos é a principal responsável pelo nível de colesterol no sangue e depende da atividade da enzima Hidroximetilglutaril Coenzima A (HMG- CoA) redutase, enzima-chave para a síntese intracelular do colesterol hepático. A inibição da HMG-CoA redutase e, portanto, da síntese intracelular do colesterol é um importante alvo terapêutico no tratamento da hipercolesterolemia. Com a queda do conteúdo intracelular do colesterol, ocorrem o aumento da expressão de LDLR nos hepatócitos e a maior captura de LDL, IDL e VLDL circulantes por estas células.
• Recentemente, a identificação e a caracterização da Pró-proteína Convertase Subtilisina/Kexina Tipo 9 (PCSK9) introduziram novos conhecimentos ao metabolismo do colesterol. A PCSK9 é uma protease expressa predominantemente pelo fígado, intestino e rins, capaz de inibir a reciclagem do LDLR de volta à superfície celular, resultando em menor número de receptores e aumento dos níveis plasmáticos de LDL.6 A inibição da PCSK9, outro potencial foco na terapêutica da hipercolesterolemia, bloqueia a degradação do LDLR, com maior capacidade de clearance da LDL circulante.
• O transporte de colesterol e triglicérides do fígado aos tecidos corresponde à via endógena.
• As partículas de HDL são formadas no fígado, no intestino e na circulação. Seu principal conteúdo proteico é representado pelas apos AI e AII. O colesterol livre da HDL, recebido das membranas celulares, é esterificado por ação da Lecitina- Colesterol Aciltransferase (LCAT). A ApoA-I, principal proteína da HDL, é cofator desta enzima. O processo de esterificação do colesterol, que ocorre principalmente nas HDL, é fundamental para sua estabilização e seu transporte no plasma, no centro desta partícula. A HDL transporta o colesterol até o fígado, no qual ela é captada pelos receptores SR-B1.
• O circuito de transporte do colesterol dos tecidos periféricos para o fígado é denominado transporte reverso do colesterol. Neste transporte, é importante a ação do complexo ATP-Binding Cassette A1 (ABC-A1) que facilita a extração do colesterol da célula pelas HDL. A HDL também tem outras ações que contribuem para a proteção do leito vascular contra a aterogênese, como a remoção de lípides oxidados da LDL, a inibição da fixação de moléculas de adesão e monócitos ao endotélio, e a estimulação da liberação de óxido nítrico.
• O transporte de colesterol e triglicérides dos tecidos de volta ao fígado corresponde ao transporte reverso de colesterol.
• Além das diferenças em tamanho, densidade e composição química, as lipoproteínas podem diferir entre si em relação à modificação in vivo por oxidação, glicação ou dessialização. Estas modificações influenciam em seu papel no metabolismo lipídico e no processo aterogênico. Os ciclos exógeno e endógeno, e o transporte reverso de colesterol são apresentados na Figura 1.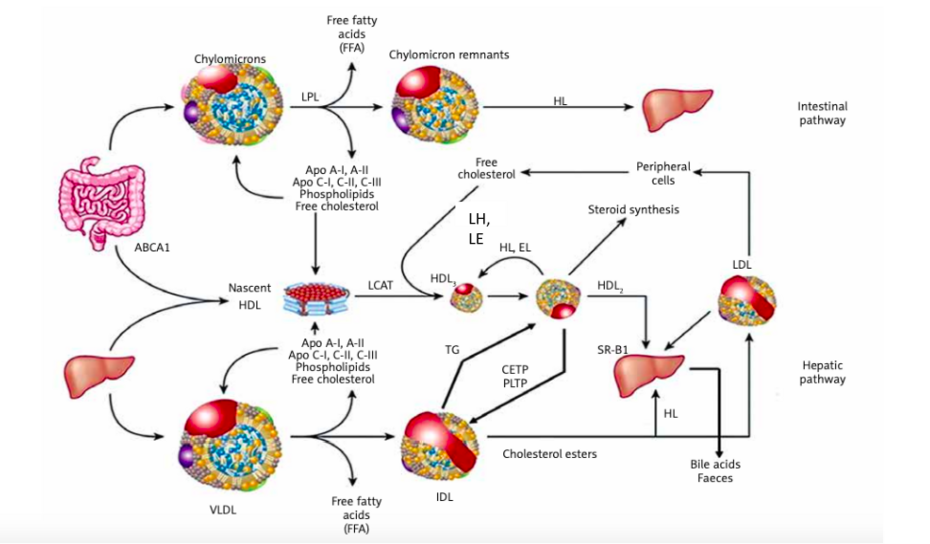
Figura 1. Representação esquemática do metabolismo e transporte das lipoproteínas
A primeira lipoproteína formada é o QM, rica em TG e pobre em colesterol. Da sua hidrólise formam-se remanescentes que são captados pelo fígado. É a via intestinal ou exógena. No fígado formam-se as VLDLs, ainda ricas em TG que também sofrem hidrólise e tornam-se LP de densidade intermediária e LDLs, além da Lp(a). Da delipidação das VLDLs e dos QM formam-se as HDLs. Formadas pela Apo A, fosfolípides e colesterol, que é esterificado pela LCAT (lecitina-colesterol acil transferase) formando partículas esféricas, capazes de serem aceptadoras de colesterol dos tecidos. As LDLs fornecem colesterol para os tecidos, são precursoras de vitaminas e hormônios esteroides e também podem se acumular nos tecidos.Referências:
1 – Faludi AA, Izar MCO, Saraiva JFK, Chacra APM, Bianco HT, Afiune Neto A et al. Atualização da Diretriz Brasileira de Dislipidemias e Prevenção da Aterosclerose – 2017. Arq Bras Cardiol 2017; 109(2Supl.1):1-76. - O que é e o que causa a síndrome da quilomicronemia familiar (SQF)?
A síndrome da quilomicronemia familiar (SQF) é uma forma grave de dislipidemia caracterizada por acúmulo de quilomícrons na circulação e aumento importante da concentração plasmática de triglicérides. A SQF compreende um conjunto de múltiplos sinais e sintomas causados pela deficiência da enzima lipoproteína lipase (LPL), enzima que “quebra” os triglicérides, ou de um de seus cofatores, comprometendo o metabolismo de triglicérides. Sua causa é genética e apresenta modo de herança autossômico recessivo, acometendo cerca de 1 a 2 pessoas por milhão de indivíduos, mas pode ser mais frequente quando existe consanguinidade entre os pais de um indivíduo afetado. Existe grande desconhecimento sobre essa condição e, por esse motivo, o seu diagnóstico ocorre tardiamente, quando complicações já se instalaram.
Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203.
- Por que as taxas de triglicérides ficam tão altas (qual o valor considerado alto e o valor considerado normal)?
A SQF é uma condição genética, onde existe um defeito herdado de ambos os pais levando à dificuldade na quebra dos triglicérides no intestino e no fígado. Não ocorrendo a quebra dos triglicérides, estes se acumulam na circulação e levam ao aspecto cremoso do soro. Do ponto de vista laboratorial, define-se hipertrigliceridemia (HTG), quando a concentração plasmática de triglicérides estiver >150mg/dL. No entanto, quando a coleta do perfil lipídico não for realizada em jejum, considera-se hipertrigliceridemia com valores >175mg/dL.
Podemos classificar as hipertrigliceridemias em discretas: triglicérides plasmáticos >150mg/dL; moderadas: entre 151 e 499mg/dL; graves: entre 500 e 1.000mg/dL e muito graves: quando chegarem a valores >1.000mg/dL. Valores normais são aqueles obtidos em jejum, até 150 mg/dL ou até 175 mg/dL sem jejum.Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203.
- Quais os sintomas e sinais da SQF?
O paciente portador de SQF se apresenta com hipertrigliceridemia (HTG), dores abdominais recorrentes, episódios de pancreatite, xantomas eruptivos, manifestações neurológicas, lipemia retinalis, hepatoesplenomegalia, além do aspecto leitoso do soro.
Na avaliação laboratorial, os pacientes afetados têm hiperquilomicronemia, apresentando-se com grande aumento dos triglicérides – em geral, na faixa de 1.500 a mais de 5.000 mg/dL, podendo chegar a valores muito maiores.
Dor abdominal recorrente é uma manifestação presente em até 50% dos pacientes e não é necessariamente associada com os quadros de pancreatite aguda, podendo ser incapacitante. Em média, a partir do nível de triglicérides >1.000mg/dL, ocorre aumento da incidência de 3% no risco de pancreatite a cada elevação de 100mg/dL de triglicérides. Outras condições em que há elevação de triglicérides também se associam a pancreatite, porém na SQF o risco chega a ser 10 vezes maior do que em outras formas graves de hipertrigliceridemia.
Manifestações neurológicas, como fadiga, confusão mental, irritabilidade e déficits cognitivos – descritos como “mental fog” – estão entre os sintomas mais comumente descritos entre os pacientes acometidos com SQF.
Xantomas eruptivos são lesões cutâneas eruptivas, de coloração amarelada, geralmente com halo eritematoso e cerca de 2 a 5 mm de diâmetro. São encontrados em superfícies extensoras (cotovelos e joelhos), dorso e nádegas. Sua prevalência é baixa (acomete de 17 a 33% dos pacientes), e nem sempre se correlacionam com a ocorrência dos episódios de pancreatite.
A lipemia retinalis refere-se à aparência leitosa do sangue nos vasos retinianos ao fundo de olho, e pode ser observada em até 30% dos pacientes, correlacionando-se com níveis maiores de triglicérides.
A hepatosplenomegalia (aumento do fígado e baço) é um dos achados reversíveis com o tratamento e resulta do acúmulo de um excesso de quilomícrons em células inflamatórias nesses órgãos.
Os quilomícrons correspondem à primeira partícula lipídica formada a partir da ingestão de alimentos gordurosos e em condições normais é rapidamente removida da circulação. A presença de quilomícrons mesmo em jejum, como ocorre na SQF, torna-o de aspecto leitoso, sendo possível sua observação a olho nu, quando colhido com um tubo coletor de sangue total com sistema de separação de fases na centrifugação, obtendo-se o soro no sobrenadante. O soro leitoso obtido deverá ficar em repouso na geladeira por 12 horas para ser observada a formação de uma capa cremosa, na superfície do tubo, indicando a presença de quilomícrons.Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203.
