Faq
Perguntas frequentes
- Como é feito o diagnóstico da SQF?
Na SQF a principal anormalidade lipoproteica nas formas graves e muito graves é a quilomicronemia, definida como a presença de quilomícrons circulantes no estado de jejum. Com concentrações de triglicérides >1.000mg/dL já se pode detectar a presença de quilomícrons no sangue; contudo, a quilomicronemia é mais provável quando essas concentrações ultrapassarem 1.500mg/dL. A relevância clínica das formas graves e muito graves da HTG deve-se à sua associação com um risco duas vezes maior de pancreatite aguda, cuja incidência aumenta em 3% para cada 100mg/dL >1.000mg/dL de trigliceridemia.
Algumas escalas ou escores de pontuação a partir das manifestações clínicas têm sido propostos para diagnóstico de SQF. O escore mais utilizado é o de Moulin que utiliza como critério de seleção a presença de hipertrigliceridemia grave (triglicérides >1.000mg/dL em jejum e fora da fase aguda), e pontua quando há presença de valores elevados de triglicérides (afastadas causas secundárias), história de pancreatite, dor abdominal recorrente, falta de resposta ao tratamento usual para redução de triglicérides, além de idade de início dos sintomas. O diagnóstico de SQF é muito provável se a soma dos pontos do escore de Moulin for > 10 pontos, improvável se < 9 pontos, ou muito improvável se < 8 pontos. Em nosso país recomenda-se o escore diagnóstico para triagem para um teste genético.
O teste genético dá o diagnóstico definitivo de SQF. Mutações em 5 genes diferentes têm sido implicadas no desenvolvimento de SQF, todas com efeito sobre a atividade da LPL, responsável pela remoção dos triglicérides dos quilomícrons e de outras lipoproteínas ricas em triglicérides na circulação, quebrando-os em ácidos graxos livres. Pacientes com SQF têm perda de função do gene que codifica a lipoproteína lipase (LPL), levando a níveis de quilomícrons extremamente elevados na circulação e, portanto, HTG grave. Outros genes também foram descritos como cofatores na ativação da LPL, a saber: APOC2, APOA5, LMF1 (do inglês, lipase maturation factor 1), e GPIHBP1 (do inglês, glycosylphosphatidylinositol anchored high-density lipoprotein binding protein 1). Os indivíduos serão considerados como portadores de SQF se apresentarem homozigose, os heterozigotos compostos ou duplos para um desses cinco genes canônicos para a SQF. O teste genético, se positivo, confirma a presença de SQF e deve ser empregado para guiar o tratamento, para rastreio de familiares de primeiro grau, para aconselhamento genético e planejamento familiar.Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203.
- Quais os tratamentos para SQF? A doença tem cura?
Normalmente, esses pacientes têm pouca resposta a medicamentos para reduzir os triglicérides plasmáticos, como os fibratos e os ácidos graxos ômega-3, e seu tratamento representa um desafio clínico. A doença por ser genética não tem cura. A base da terapia da SQF é representada por uma redução drástica da ingestão de gorduras (8 a 10% do total de calorias), terapêutica esta difícil de ser mantida ao longo do tempo. A adesão a restrições alimentares dessa magnitude ao longo da vida do paciente é difícil, afeta negativamente a qualidade de vida e não elimina completamente o risco de pancreatite em todos os pacientes. Além da dieta restrita em gorduras e carboidratos simples, existem novos tratamentos para a SQF.
A Volanesorsena é um tratamento inovador na SQF. Trata-se de uma molécula que possui uma sequência de oligonucleotídeos antisentido, ou seja complementar à sequência do RNA mensageiro que codifica a apolipoproteína C3 (APOC3), impedindo a sua síntese. A APOC3 é uma proteína que no nosso organismo inibe a quebra de triglicérides pela lipoproteína lipase, e que é deficiente na SQF. No estudo APPROACH, em pacientes com SQF, a Volanesorsena reduziu em 84% os níveis de APOC3 e os triglicérides em 77%, permitindo que os pacientes alcançassem valores de triglicérides <750 mg/dL quando associado à dieta restrita. Esse fármaco, que é injetável, deve ser aplicado uma vez por semana por via subcutânea em pacientes com diagnóstico genético confirmado de SQF, ou com atividade da LPL < 20%.Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203.
- Como deve ser a dieta de um paciente com SQF?
O tratamento da SQF baseia-se no seguimento de dieta com restrição severa de gorduras, com a finalidade de prevenir a síntese de quilomícrons, partículas formadas exclusivamente no intestino e que são responsáveis pelo transporte da gordura e colesterol de origem alimentar. Pelo fato de os portadores de SQF apresentarem mutações associadas à enzima lipoproteína lipase ou a seus cofatores, a hidrólise dos triglicérides alimentares se encontra comprometida. Por esse motivo, a dieta recomendada é bastante restrita e deve fornecer, no máximo, 10% das calorias ou 15 a 20g na forma de gorduras. Embora a restrição de gorduras seja o ponto mais importante no tratamento da SQF, a dieta também deve ser isenta de açúcares de adição, como sacarose e xarope de milho. A dieta também deve ser isenta de álcool, cujo consumo se associa com as concentrações de triglicérides. Além disso, o monitoramento da ingestão de vitaminas lipossolúveis, minerais e ácidos graxos essenciais é recomendado, e a sua suplementação pode ser necessária.
Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203.
- Quantos gramas de gordura um paciente com SQF pode ingerir por dia? Por quê? Poderia dar um exemplo prático de cardápio?
Na SQF deve-se restringir a ingestão de gordura na dieta em 10% a 15% do valor energético total. Assim, para uma dieta de 1500 kcal, recomenda-se até 150 a 225 calorias de gorduras por dia. Nessa dieta, o café da manhã pode conter 200 mL de leite desnatado, 2 fatias de pão integral, 1 colher de queijo cottage, ½ unidade de mamão papaia, e uma colher de sopa de aveia. No lanche da manhã, um figo. No almoço um prato raso de salada de folhas verdes, tomate, palmito e pepino, com uma colher de sopa de molho, três colheres de sopa de arroz cozido sem óleo, uma concha de feijão cozido sem óleo, uma posta de cação cozida sem óleo e com molho de manjericão e tomate, uma colher de brócolis refogado com alho e cebola e uma fatia de abacaxi. No lanche da tarde, 200 mL de iogurte desnatado, uma fatia de pão integral, uma colher de sobremesa de geleia sem açúcar e uma colher e meia de ricota light. No jantar, um prato raso de salada de folhas verdes, tomate, palmito e pepino, com uma colher de sopa de molho, omelete de clara (feito com duas claras) recheado com espinafre, tomate e abobrinha, uma unidade de batata assada com alho, sal grosso e alecrim e uma unidade de banana assada com canela. Para a ceia, 200 mL de iogurte desnatado.
Existem adequações de cardápio para 1800 cal, para crianças, gestantes. Nos lactentes, o aleitamento materno deve ser descontinuado e deve ser prescrito o leite desnatado. Os triglicérides de cadeia média podem ser suplementados para garantir o aporte calórico necessário, especialmente em crianças e gestantes. Todo o acompanhamento deve ser feito por profissional nutricionista especializado. Existem livros de receitas e aplicativos que auxiliam no cardápio e na contagem de calorias para os pacientes portadores de SQF.Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203.
- O que a gordura causa no organismo de um paciente com SQF? O que ele pode comer no lugar da gordura?
Em pacientes com SQF a ingestão de gorduras além do recomendado eleva os níveis de triglicérides, uma vez que quem tem essa condição não consegue digerir as gorduras, levando ao acúmulo de quilomícrons. O paciente apresenta sintomas como dores abdominais frequentes, empachamento, diarreia, fadiga, fuga de pensamento, xantomas eruptivos, e pode ter episódios de pancreatite, situação muito grave, podendo ser fatal. Alternativas de cardápio com consumo restrito de gorduras, onde carboidratos complexos, proteínas de fontes pobres em gorduras e suplementação de compostos à base de triglicérides de cadeia média (TCM) que não elevam os quilomícrons, podem ser recomendados por nutricionista.
Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203
- Quais problemas de saúde e complicações um paciente com SQF pode ter se não seguir a dieta corretamente?
A complicação mais temida para um paciente com SQF é a pancreatite hipertrigliceridêmica, que é menos frequente do que aquela decorrente de cálculos biliares, porém, se associa com maior mortalidade e pior prognóstico. Existe um risco maior de pancreatite quando os triglicérides estão acima de 1.000 mg/dL. Esse risco, bem como a gravidade, aumenta ainda mais naqueles pacientes com valores >2.000mg/dL. Na gestação, por ação hormonal, pacientes com SQF têm um risco aumentado de pancreatite. A falta de adesão à dieta pode aumentar o risco de pancreatites e muitos pacientes evitam reuniões sociais e festas, porque temem comer e desencadear pancreatite.
Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203.
- De que forma a SQF impacta na vida pessoal, social e profissional de um paciente?
A SQF traz impacto nos domínios físico, psicológico e social ao paciente que comprometem sua sociabilidade e qualidade de vida. O estudo IN-FOCUS, avaliou 166 pacientes com SQF e mostrou o importante impacto da doença na qualidade de vida. Sentimento de impotência diante da doença, sintomas de fadiga e confusão mental são aspectos de campo interdisciplinar que podem persistir durante toda a vida dos pacientes com SQF. A preocupação quanto ao efeito da doença na saúde e na vida, ao longo do tempo, o desejo de ser capaz de viver uma vida normal e a preocupação com o impacto financeiro da doença afetam sobremaneira a estabilidade emocional dos pacientes e cuidadores, podendo produzir sentimentos de baixa autoestima e ansiedade, interferir na habilidade de raciocínio e de elaboração de soluções, e reduzir a qualidade do sono. Depressão, sentimentos de constrangimento, vergonha e inadequação social, percepção de mudanças no funcionamento cognitivo, por influência de dificuldades de concentração e memória, são aspectos da doença que corroboram para o declínio na qualidade de vida pessoal e profissional dos afetados. Segundo os pacientes conviver com a SQF consome o tempo e exaure a energia física e mental, tornando-os incapazes de se projetarem na vida. Adultos com diagnóstico de SQF podem expressar significativos prejuízos psicológicos relacionados à falta de autonomia e de liberdade na condução da vida, para além da doença. Espera-se que uma abordagem multiprofissional, o tratamento medicamentoso e a adesão às restrições alimentares reduzam a carga da doença nesses pacientes.
Referência: Izar MCO, Santos-Filho RD, Assad MHV, Chagas ACP, AO Toledo- Júnior AO, Nogueira ACC, et al. Posicionamento Brasileiro sobre Síndrome da Quilomicronemia Familiar – 2023. Arq Bras Cardiol. 2023;120(4):e20230203. - Questões que foram elaboradas pelo Expert Consensus Decision Pathways (ECDPs)
Perguntas frequentes em hipertrigliceridemias
Por: Dra. Maria Cristina IzarIremos abordar questões que foram elaboradas pelo Expert Consensus Decision Pathways (ECDPs), que constituem um elemento essencial nos conjuntos de soluções voltadas à prática clínica baseada em evidências. A metodologia dos ECDPs fundamentou-se na formação de um grupo de especialistas clínicos com o propósito de desenvolver conteúdos que respondam a questões relevantes enfrentadas pelos profissionais de saúde em diversas áreas de alto impacto clínico1.
Esses conteúdos serviram de base para a criação de ferramentas que visam facilitar a aplicação, em tempo real, de políticas clínicas para o manejo de pacientes. Os ECDPs não têm como objetivo estabelecer uma única resposta correta; ao contrário, incentivam os clínicos a refletirem criticamente, formularem perguntas pertinentes e considerarem múltiplos fatores na definição do plano terapêutico mais adequado para cada paciente.
Sempre que possível, os ECDPs buscam integrar e articular de forma coerente as diretrizes de prática clínica, os critérios de uso apropriado e outras políticas clínicas do American College of Cardiology (ACC). Em determinadas situações, os temas abordados poderão ser incorporados futuramente a diretrizes de prática clínica, à medida que novas evidências científicas se tornem disponíveis. Em outros casos, os ECDPs permanecerão como documentos de política clínica independentes.Questão 1. Qual é a definição de hipertrigliceridemia persistente?
A hipertrigliceridemia persistente é definida como níveis de triglicerídeos em jejum ≥150 mg/dL, após um período mínimo de 4 a 12 semanas de intervenção com mudanças de estilo de vida, uso de uma dose estável da terapia com estatina na máxima dose tolerada, quando indicada, e avaliação e manejo das causas secundárias de hipertrigliceridemia1. Antes do início de terapias não estatínicas baseadas no risco associado aos triglicérides, deve-se obter um perfil lipídico em jejum. Recomenda-se que a tomada de decisão clínica seja baseada nos resultados de pelo menos duas medições de lipídios em jejum, preferencialmente realizadas com intervalo mínimo de duas semanas1.Questão 2. Qual a recomendação para dosagem do perfil lipídico com ou sem jejum?
O aumento do risco de doença aterosclerótica cardiovascular (ASCVD) em pacientes com hipertrigliceridemia é mediado, ao menos em parte, pelo colesterol transportado por partículas remanescentes ricas em triglicerídeos e por partículas de LDL. Na maioria dos pacientes, o aumento pós-prandial dos triglicerídeos é pequeno, variando entre 12 e 27 mg/dL. As Diretrizes de Colesterol de 2018 da AHA/ACC2 e de sociedades associadas recomendam que, em adultos com idade ≥20 anos que não estejam em uso de terapias redutoras de lipídios, tanto o perfil lipídico em jejum quanto o sem jejum podem ser utilizados para estimar o risco de ASCVD e documentar o LDL-C basal3-5. Para indivíduos com triglicerídeos sem jejum ≥400 mg/dL, recomenda-se a repetição do exame com perfil lipídico em jejum, a fim de avaliar os níveis de triglicerídeos e de LDL-C basal.
O método de Martin-Hopkins fornece uma avaliação mais precisa do LDL-C em indivíduos com hipertrigliceridemia6-7. Além disso, um novo método de cálculo do LDL-C, proposto por pesquisadores do National Heart, Lung, and Blood Institute (NHLBI)8, pode oferecer maior precisão em casos de hipertrigliceridemia, embora ainda necessite de validação adicional.
Em pacientes com níveis de triglicerídeos ≥500 mg/dL, a prioridade clínica deve ser reduzir os triglicerídeos para diminuir o risco de pancreatite; após essa redução, a mensuração do LDL-C torna-se mais precisa1.Questão 3. Em que situações é preferível a dosagem do perfil lipídico em jejum?
A avaliação do perfil lipídico em jejum é preferida nas seguintes situações:1
a) Para estabelecer o diagnóstico de síndrome metabólica, visto que um dos critérios diagnósticos é triglicerídeos em jejum ≥150 mg/dL;
b) Para identificar distúrbios lipídicos em indivíduos sem doença aterosclerótica cardiovascular (ASCVD) clínica, mas com histórico familiar de ASCVD prematura ou dislipidemias genéticas;
c) Para avaliar a adesão ao tratamento e ao estilo de vida em pacientes que utilizam terapia redutora de lipídios com o objetivo de diminuir o risco de ASCVD;
d) Para identificar indivíduos com triglicerídeos ≥500 mg/dL, em risco de pancreatite induzida por hipertrigliceridemia, e monitorar sua resposta ao tratamento.Questão 4. Quais as Causas Secundárias de Hipertrigliceridemia?
É fundamental que os profissionais de saúde investiguem e tratem as causas secundárias de hipertrigliceridemia. Essas causas incluem doenças associadas a elevações moderadas ou graves dos triglicerídeos, fatores dietéticos e de estilo de vida, fármacos que induzem hipertrigliceridemia e distúrbios metabólicos.
O mau controle glicêmico pode impactar significativamente os níveis lipídicos plasmáticos em pacientes com diabetes mellitus, agravando a hipertrigliceridemia. Além disso, a predisposição genética aumenta tanto a probabilidade quanto a gravidade das elevações dos triglicerídeos em todas as categorias2,9.
A síndrome de quilomicronemia multifatorial é a causa mais comum entre as três condições que elevam os triglicerídeos a níveis capazes de provocar manifestações clínicas de excesso de quilomicronemia, como lipemia retinalis, xantomas eruptivos, dor abdominal e pancreatite hiperlipidêmica10.
Essa síndrome é 40 a 60 vezes mais prevalente que outras duas condições monogênicas raras — a síndrome de quilomicronemia familiar autossômica recessiva e a lipodistrofia parcial familiar — que também predispõem a elevações graves de triglicerídeos11.
Dado que a pancreatite associada à hipertrigliceridemia pode ser fatal, é essencial que os clínicos reconheçam as condições e medicamentos que, aliados a uma predisposição genética subjacente, aumentam o risco dessa complicação.Questão 5. Qual é o papel da intervenção no estilo de vida antes da consideração de terapias não estatínicas baseadas no risco associado aos triglicérides?
Em consonância com as Diretrizes de Colesterol da AHA/ACC de 20182 e as Diretrizes de Prevenção Primária da Doença Cardiovascular de 201912, o 2021 ACC Expert Consensus Decision Pathway on the Management of ASCVD Risk Reduction in Patients With Persistent Hypertriglyceridemia1 enfatiza que a modificação do estilo de vida — incluindo adesão a uma dieta cardioprotetora, atividade física regular, abstinência de tabaco, limitação do consumo de álcool e manutenção de peso saudável — continua sendo um pilar fundamental na redução do risco de ASCVD, tanto antes, quanto em conjunto com terapias farmacológicas.
Pacientes com hipertrigliceridemia moderada ou grave apresentam resposta significativa a intervenções intensivas no estilo de vida e ao controle de causas secundárias. Portanto, essas intervenções constituem a base do tratamento.
É fortemente recomendada a referência a um nutricionista para promover maior compreensão dos princípios de uma alimentação cardioprotetora e individualizar as orientações nutricionais.
Como a hipertrigliceridemia frequentemente se associa a outros fatores de risco metabólicos — como obesidade abdominal, hipertensão e hiperglicemia —, a adesão às recomendações dietéticas pode beneficiar todo o perfil metabólico ao longo da vida.
A adesão deve ser avaliada regularmente, tanto no início ou ajuste da terapia com estatinas quanto nas visitas de acompanhamento.
Antes da introdução de terapias não estatínicas baseadas no risco associado aos triglicérides, é crucial que os clínicos reforcem a adesão e ofereçam suporte para mudanças intensivas no estilo de vida.Questão 6. Qual é o papel da terapia com estatinas em pacientes com hipertrigliceridemia persistente?
Embora sejam amplamente reconhecidas pelo efeito na redução do LDL-C, as estatinas também proporcionam uma redução dose-dependente de 10% a 30% nos triglicerídeos em pacientes com níveis elevados de triglicérides.
Estudos clínicos demonstram que indivíduos com triglicerídeos aumentados têm maior risco de eventos ASCVD e podem reduzir esse risco com o uso de estatinas.
No estudo 4S (Scandinavian Simvastatin Survival Study), pacientes com triglicerídeos elevados e HDL-C baixo apresentaram maior taxa de eventos ASCVD, mas também maior benefício com a sinvastatina em comparação àqueles com elevação isolada do LDL-C.
No estudo PROVE IT–TIMI 22, níveis de LDL-CEm prevenção primária, para pacientes sem diabetes mellitus e LDL-CQuestão 7. Quais os Grupos de Manejo de Pacientes devem ser considerados na avaliação do risco associado aos triglicérides?
O comitê de especialistas iniciou suas deliberações ratificando a estrutura dos grupos de manejo clínico, o papel da intervenção no estilo de vida, e o uso de estatinas e terapias não estatínicas redutoras de LDL-C, conforme estabelecido nas Diretrizes de Colesterol da AHA/ACC de 20182.
Posteriormente, avaliou-se o potencial benefício líquido na redução do risco de ASCVD com a adição de terapias não estatínicas baseadas no risco associado aos triglicérides, em cada um dos seguintes grupos de pacientes:a) Prevenção secundária: pacientes com ASCVD clínica e triglicerídeos em jejum ≥150 mg/dL ou triglicerídeos sem jejum ≥175 mg/dL, e com valores de triglicerídeos b) Adultos ≥40 anos com diabetes mellitus, sem ASCVD, com triglicerídeos em jejum ≥150 mg/dL ou sem jejum ≥175 mg/dL, e com valores de triglicerídeos c) Adultos ≥20 anos, sem ASCVD ou diabetes mellitus, com triglicerídeos em jejum ≥150 mg/dL ou sem jejum ≥175 mg/dL, e com valores de triglicerídeos d) Adultos ≥20 anos com hipertrigliceridemia grave, definidos como triglicerídeos ≥500 mg/dL, especialmente aqueles com níveis ≥1.000 mg/dL.
A Figura 1 resume esses grupos de pacientes.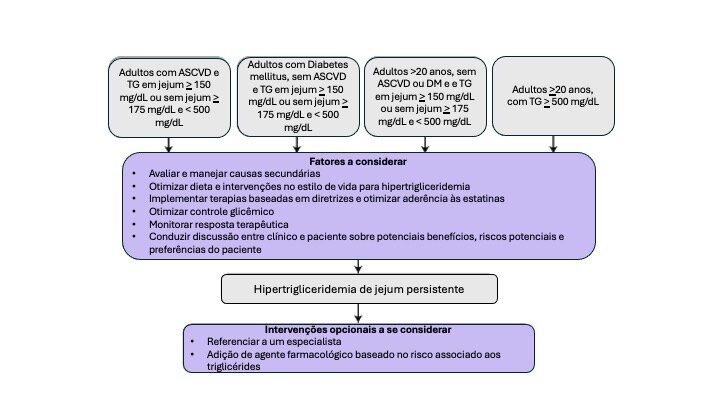
Figura 1. Grupos de Manejo de Pacientes que devem ser considerados na avaliação do risco associado aos triglicérides.
Adaptado de Virani SS, et al.1Questão 8. Qual o papel da Hipertrigliceridemia Persistente na estratificação de risco na Prevenção Primária?
De acordo com as Diretrizes de Colesterol da AHA/ACC de 20182, o risco de ASCVD em 10 anos, calculado pelas Equações de Coorte Agrupadas (Pooled Cohort Equations – PCE), é uma ferramenta útil para estimar o risco populacional.
No entanto, os clínicos devem estar atentos às suas limitações, pois essa ferramenta pode superestimar o risco em pessoas de nível socioeconômico mais elevado ou que recebem rastreamento e cuidados preventivos regulares.
A discussão entre médico e paciente deve individualizar a avaliação do risco, considerando não apenas o cálculo pelo PCE, mas também fatores de risco adicionais (“risk-enhancing factors”). Esses fatores podem indicar um risco maior ao longo da vida do que o previsto pela estimativa de 10 anos.
Entre esses fatores, destaca-se a elevação persistente dos triglicerídeos (triglicerídeos sem jejum ≥175 mg/dL), reconhecida como fator de risco potencializador nas diretrizes de 20182.Questão 9. Em quais populações de pacientes devem ser consideradas as terapias não estatínicas baseadas no risco associado aos triglicérides?
As terapias não-estatínicas devem ser consideradas no manejo de pacientes com hipertrigliceridemia persistente, em quatro cenários, ilustrados pelas Figuras 2-5.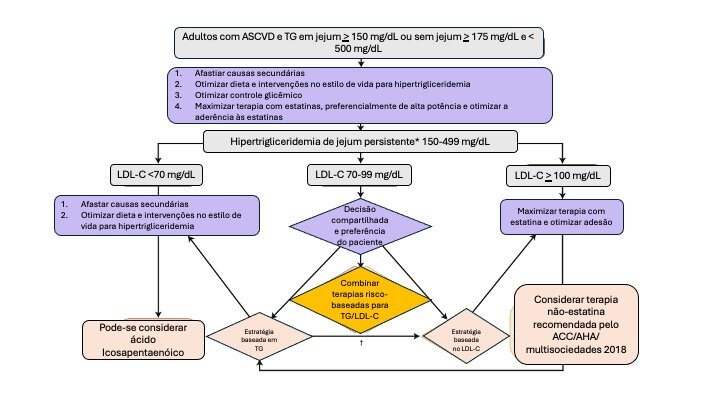
Figura 2. Manejo de pacientes adultos com ASCVD clínica e triglicerídeos em jejum ≥150 mg/dL ou triglicerídeos sem jejum ≥175 mg/dL, e com valores de triglicerídeos Adaptado de Virani SS, et al.1
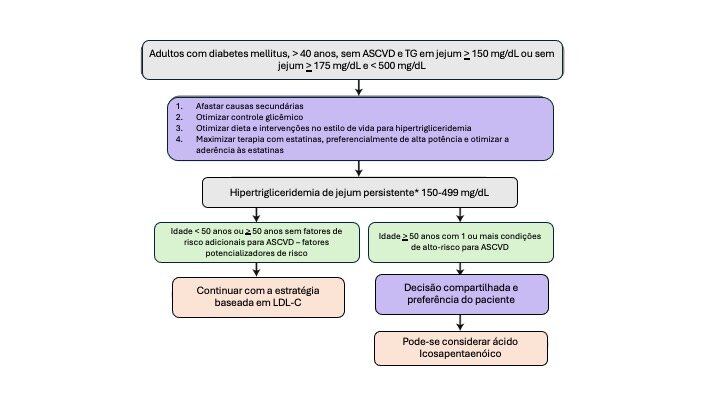
Figura 3. Manejo de pacientes adultos ≥40 anos com diabetes mellitus, sem ASCVD, com triglicerídeos em jejum ≥150 mg/dL, ou sem jejum ≥175 mg/dL, e com valores de triglicerídeos Adaptado de Virani SS, et al.1
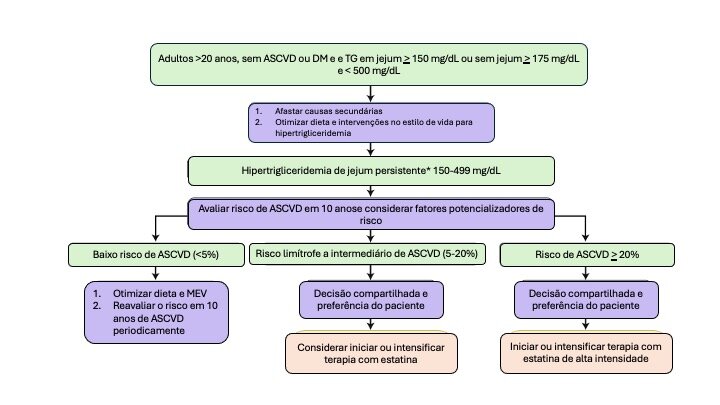
Figura 4. Manejo de pacientes adultos ≥20 anos, sem ASCVD ou diabetes mellitus, com triglicerídeos em jejum ≥150 mg/dL ou sem jejum ≥175 mg/dL, e com valores de triglicerídeos Adaptado de Virani SS, et al.1
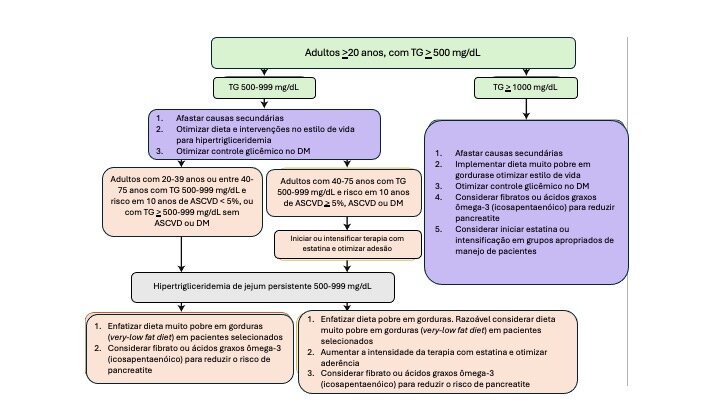
Figura 5. Manejo de pacientes adultos ≥20 anos com hipertrigliceridemia grave, definidos como triglicerídeos ≥500 mg/dL, especialmente aqueles com níveis ≥1.000 mg/dL.
Adaptado de Virani SS, et al.1Questão 10. Caso as terapias não estatínicas baseadas no risco associado aos triglicérides sejam adicionadas, quais agentes ou medicamentos devem ser considerados e em que ordem?
De acordo com o 2021 ACC Expert Consensus Decision Pathway on the Management of ASCVD Risk Reduction in Patients With Persistent Hypertriglyceridemia, a adição de terapias não-estatínicas deve seguir as sugestões dos fluxogramas (Figuras 2-5).Referências:
1. Virani SS, Morris PB, Agarwala A, et al. 2021 ACC expert consensus decision pathway on the management of ASCVD risk reduction in patients with persistent hypertriglyceridemia: a report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2021;78(9):960-993.
2. Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2019;73: e285–e350.
3. Langsted A, Freiberg JJ, Nordestgaard BG. Fasting and nonfasting lipid levels: influence of normal food intake on lipids, lipoproteins, apolipoproteins, and cardiovascular risk prediction. Circulation. 2008;118: 2047–2056.
4. Chapman MJ, Ginsberg HN, Amarenco P, et al. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J. 2011;32:1345–1361.
5. Cartier LJ, Collins C, Lagacé M, et al. Comparison of fasting and non-fasting lipid profiles in a large cohort of patients presenting at a community hospital. Clin Biochem. 2018;52:61–66.
6. Martin SS, Blaha MJ, Elshazly MB, et al. Friedewald-estimated versus directly measured low-density lipoprotein cholesterol and treatment implications. J Am Coll Cardiol. 2013;62:732–739.
7. Martin SS, Blaha MJ, Elshazly MB, et al. Compari- son of a novel method vs the Friedewald equation for estimating low-density lipoprotein cholesterol levels from the standard lipid profile. JAMA. 2013;310:2061– 2068.
8. Sampson M, Ling C, Sun Q, et al. A new equation for calculation of low-density lipoprotein cholesterol in patients with normolipidemia and/or hyper- triglyceridemia. JAMA Cardiol. 2020;5:540–548.
9. Vodnala D, Rubenfire M, Brook RD. Secondary causes of dyslipidemia. Am J Cardiol. 2012;110:823– 825.
10. Chait A, Eckel RH. The chylomicronemia syndrome is most often multifactorial: a narrative review of causes and treatment. Ann Intern Med. 2019;170:626– 634.
11. Warden BA, Minnier J, Duell PB, et al. Chylomicronemia syndrome: familial or not? J Clin Lipidol. 2020;14:201–206.
12. Lloyd-Jones DM, Braun LT, Ndumele CE, et al. Use of risk assessment tools to guide decision-making in the primary prevention of atherosclerotic cardiovascular disease: a special report from the American Heart Association and American College of Cardiology. J Am Coll Cardiol. 2019;73:3153–3167.
